Sisu
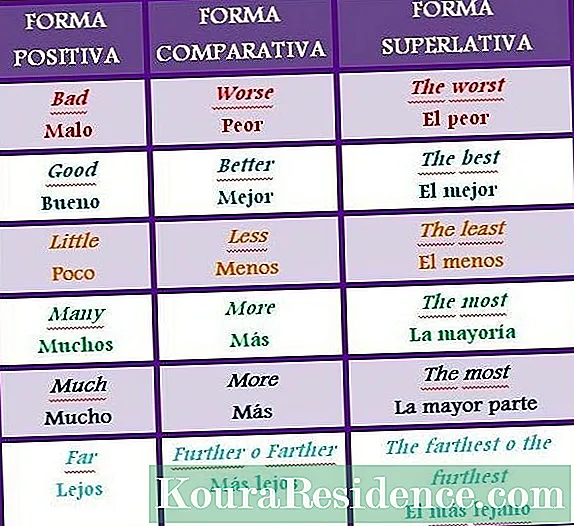
Ained oksüdeerijad (O) on oksüdeerivad ained, mis teatud temperatuuri ja rõhu tingimustes võivad seguneda kütusega ja toota täpselt: a põlemine. Selles protsessis taandub oksüdeerija kütuseks ja viimane oksüdeeritakse esimese abil.
Oksüdeerijad on oksüdeerivad ained, millel on altid väga eksotermilistele redutseerimis-oksüdatsioonireaktsioonidele (nad toodavad soojust), seetõttu peetakse paljusid seda tüüpi aineid ohtlike või ettevaatliku käitlemise hulka, kuna need võivad põhjustada tõsiseid põletushaavu.
Nimetatakse laienduseks ka oksüdeerijaks mis tahes keskkond, milles on võimalik põlemine.
Vaata ka: Näited kütustest
"Redox" reaktsioonid
The oksüdeerijadOksüdeerijatena tekitavad nad "redoksreaktsioone", see tähendab samaaegset redutseerimist ja oksüdeerumist. Seda tüüpi reaktsioonides toimub elektronivahetus sel määral, et oksüdeerija saab elektrone (redutseerib) ja reduktor kaotab elektrone (oksüdeerub). Kõik kaasatud komponendid omandavad ka oksüdatsiooni oleku.
Seda tüüpi reaktsioonide näited on plahvatuse, keemilise sünteesi või korrosiooni juhtumid.
Oksüdeerijate näited
- Hapnik (O2). Oksüdeerija par excellence, osaleb peaaegu kõigis tuleohtlikes või plahvatusohtlikes reaktsioonides. Tegelikult ei saa tavaline tulekahju selle puudumisel tekkida. Üldiselt tekitavad hapniku redoksreaktsioonid lisaks energiale ka CO koguseid2 ja vesi.
- Osoon (O3). Keskkonnaharuldane gaasiline molekul, ehkki seda leidub atmosfääri ülemistes kihtides, on seda sageli kasutatud vee puhastamisel ja teistes protsessides, mis kasutavad ära selle tugevat oksüdeerimisvõimet.
- Vesinikperoksiid (H2VÕI2). Tuntud ka kui vesinikperoksiid või dioksogeen, on see väga polaarne, väga oksüdeeriv vedelik, mida kasutatakse sageli haavade desinfitseerimiseks või juuste pleegitamiseks. Selle valem on ebastabiilne ja kipub lagunema vee ja hapniku molekulideks, vabastades selle käigus soojusenergiat. See ei ole tuleohtlik, kuid vase, hõbeda, pronksi või teatud orgaanilise aine juuresolekul võib see iseeneslikult põleda..
- Hüpokloridid (ClO-). Neid ioone leidub arvukates ühendites, nagu vedel (naatriumhüpoklorit) või pulbristatud (kaltsiumhüpoklorit) leelised, mis on väga ebastabiilsed ja kipuvad päikesevalguse, kuumuse ja muude protsesside mõjul lagunema. Nad reageerivad väga eksotermiliselt orgaanilisele ainele, põhjustades põlemist, ja mangaanile, moodustades permanganaate.
- Permanganaadid. Need on permangaaneeshappest (HMnO4), millest nad pärivad aniooni MnO4– ja seetõttu kõrgeimas oksüdatsiooniastmes mangaan. Neil on tavaliselt võimas violetne värv ja orgaanilise ainega kokkupuutel väga kõrge tuleohtlikkus., tekitades violetse leegi ja võib põhjustada tõsiseid põletushaavu.
- Peroksoväävelhape (H2SW5). Sellel värvitul tahkel ainel, mis sulab temperatuuril 45 ° C, on desinfektsioonivahendina ja puhastusvahendina ning happesoolade tekitamisel selliste elementide nagu kaalium (K) juuresolekul suur tööstuslik rakendus. Orgaaniliste molekulide, nagu eetrid ja ketoonid, juuresolekul moodustab see peroksügeenimisel väga ebastabiilsed molekulid, näiteks atsetoonperoksiid.
- Atsetoonperoksiid (C9H18VÕI6). Peroksüketoonina tuntud orgaaniline ühend on väga plahvatusohtlik, kuna reageerib väga kergesti kuumusele, hõõrdumisele või löögile. Sel põhjusel on paljud terroristid seda kasutanud oma rünnakutes detonaatorina ja mitte vähe keemikuid pole selle käitlemisel viga saanud. See on väga ebastabiilne molekul, mis lagunedes teisteks stabiilsemateks aineteks eraldab tohutul hulgal energiat (entroopiline plahvatus).
- Halogeenid. Mõned perioodilise tabeli VII rühma elemendid, mida nimetatakse halogeenideks, loovad mononegatiivseid ioone, kuna neil on vaja elektrone oma viimase energiataseme täitmiseks, moodustades seega halogeniididena tuntud soolad, mis on väga oksüdeerivad.
- Tollensi reaktiiv. Saksa keemiku Bernhard Tollensi nimeks on see diamiini vesikompleks (kaks amiinirühma: NH3) ja hõbe, mida kasutatakse eksperimentaalselt aldehüüdide tuvastamiseks, kuna nende võimas oksüdeerimisvõime muudab need karboksüülhapeteks. Tollensi reaktiiv moodustab aga pikaajalisel säilitamisel spontaanselt hõbefulinaadi (AgCNO), mis on väga plahvatusohtlik hõbesool..
- Osmiumtetroksiid(Karu4). Vaatamata osmiumi haruldusele on sellel ühendil palju huvitavaid rakendusi, kasutusviise ja omadusi. Näiteks tahkes olekus on see väga lenduv: see muutub toatemperatuuril gaasiks. Hoolimata sellest, et see on võimas oksüdeerija ja seda kasutatakse laboris katalüsaatorina mitu korda, ei reageeri see enamiku süsivesikutega, kuid see on väga mürgine koguses, mis on väiksem kui inimese lõhna järgi tuvastatav.
- Perkloorhappe soolad (HClO4). Perkloraatsoolad sisaldavad kõrge oksüdatsiooniastmega kloori, mistõttu on need ideaalsed lõhkeainete integreerimiseks, pürotehnilised seadmed ja raketikütused, kuna need on väga halvasti lahustuvad oksüdeerijad.
- Nitraadid (NO3–). Sarnaselt permanganaatidele on need soolad, milles lämmastik on märkimisväärses oksüdatsiooniastmes. Seda tüüpi ühendid ilmnevad looduslikult bioloogiliste jäätmete, näiteks karbamiidi või mõne lämmastikuvalgu lagunemisel, moodustades ammoniaaki või ammoniaaki, ja neid kasutatakse laialdaselt väetistes. See on ka musta pulbri oluline osa, kasutades selle oksüdeerimisjõudu süsiniku ja väävli muundamiseks ning kalorite energia vabastamiseks..
- Sulfoksiidid. Saadud peamiselt sulfiidide orgaanilise oksüdeerimise teel, kasutatakse seda tüüpi ühendeid paljudes farmaatsiaravimites ja suurema hapniku manulusel võivad nad jätkata oksüdeerimisprotsessi, kuni neist saavad sulfoonid, mis on kasulikud antibiootikumidena.
- Kroomtrioksiid (CrO3). See ühend on tumepunast värvi tahke aine, mis lahustub vees ja on vajalik metallide tsingimise ja kroomimise protsessides. Ainus kokkupuude etanooli või muude orgaaniliste ainetega põhjustab selle aine kohest süttimist, mis on väga söövitav, mürgine ja kantserogeenne ning samuti oluline osa kuuevalentsest kroomist, mis on keskkonnale väga kahjulik ühend.
- Ühendid tseeriumiga VI. Tseerium (Ce) on lantaniidide klassi keemiline element, pehme, hall metall, plastne, kergesti oksüdeeruv. Saadavaid erinevaid tseeriumoksiide kasutatakse tööstuslikult laialdaselt, eriti tikkude valmistamisel ja kergema kivina ("tindina") rauasulamiga., kuna ainus hõõrdumine teiste pindadega on sädemete ja kasutatava soojuse tekitamiseks piisav.
See võib teile teenida:
- Näited kütustest igapäevaelus