Sisu
Aastal anorgaaniline keemia, räägitakse a Sool kui viidame ühendid, mis saadakse siis, kui happel on vesiniku aatomid asendatud aluseliste radikaalidega, mis konkreetsel juhul happelised soolad, on negatiivset tüüpi (katioonid). Selles osas, et neid eristatakse neutraalsed soolad või binaarsed soolad.
Soolad moodustuvad tavaliselt happe ja hüdroksiidi (aluse) vahelise reaktsiooni kaudu. Nendes reaktsioonides kaotab alus tavaliselt hüdroksüülrühmad (-OH) ja happe vesinikuaatomid (H), moodustades neutraalse soola; kuid kui kõnealune hape säilitab ühe oma vesiniku aatomist, muutes reaktsiooni elektrilaengut, saame a happeline sool või hüdrogeenitud sool.
Nii saadakse liitiumhüdroksiidist ja süsinikhappest näiteks liitiumvesinikkarbonaat:
LiOH + H2CO3 = Li (HCO3) + H2VÕI
Nagu nähtub, viskab kõrvalproduktina vett ka.
Happesoolade nomenklatuur
Funktsionaalse nomenklatuuri järgi tuleks happesoolade puhul kasutada traditsioonilist viisi neutraalsete soolade nimetamiseks järelliidetest -ate või -ite, kuid eelnes eesliide, mis näitab asendatud vesinikuaatomite arvu aastal molekul. Nii näiteks liitiumvesinikkarbonaat (LiHCO3) on kaks vesiniku aatomit (bi = kaks).
Teiselt poolt on süsteemse nomenklatuuri järgi termin vesinik saadud soola tavalisele nimele, austades asendatud vesinikuaatomitele viitavaid eesliiteid. Seega on liitiumvesinikkarbonaat või liitiumvesinikkarbonaat viisid sama liitiumvesinikkarbonaadi (LiHCO) nimetamiseks3).
Happesoolade näited
- Naatriumvesinikkarbonaat (NaHCO3). Seda nimetatakse ka naatriumvesinikkarbonaadiks (IV), see on vees lahustuv valge kristalne tahke aine, mida võib looduses leida mineraalses olekus või toota laboris. See on üks kõige happelisemaid teadaolevaid sooli ja seda kasutatakse laialdaselt kondiitritoodetes, farmakoloogias või jogurti valmistamisel.
- Liitiumvesinikkarbonaat (LiHCO3). Seda happesoola on kasutatud CO sidurina2 olukordades, kus selline gaas on ebasoovitav, nagu Põhja-Ameerika "Apollo" kosmosemissioonidel.
- Kaaliumvesinikfosfaat (KH2PO4). Kristalne tahke aine, lõhnatu, vees lahustuv, laialdaselt kasutatakse erinevates tööstusharudes, nagu toidupärm, kelaativad ained, toitainete tugevdaja ja abistaja käärimisprotsessides.
- Naatriumbisulfaat (NaHSO4). Väävelhappe neutraliseerimisel tekkinud happesool, mida kasutatakse tööstuslikult laialdaselt metallide rafineerimisel, puhastusvahendites ja ehkki see on mõnele okasnahksele väga mürgine, kasutatakse seda lemmikloomatoidus ja ehete valmistamisel lisandina.
- Naatriumvesiniksulfiid (NaHS). Ohtlik õrnalt käsitsetav ühend, kuna see on väga söövitav ja mürgine. See võib põhjustada tõsiseid nahapõletusi ja silmakahjustusi, kuna on ka põlev.
- Kaltsiumvesinikfosfaat (CaHPO4). Seda kasutatakse toidulisandina teraviljas ja loomasöödas, see on vees lahustumatu tahke aine, kuid hüdreerituna kahe veemolekuli tarbimisel võimeline kristalluma.
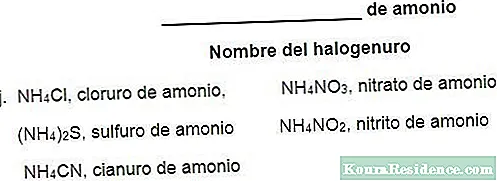
- Ammooniumvesinikkarbonaat ([NH4] HCO3). Seda tuntakse ammooniumvesinikkarbonaadina ja seda kasutatakse toiduainetööstuses keemilise pärminaEhkki selle puuduseks on ammoniaagi kinnipidamine, muudab toidu liigse kasutamise korral halva maitse. Seda kasutatakse ka tulekustutites, pigmendi valmistamisel ja kummipaisujana.
- Baariumvesinikkarbonaat (Ba [HCO3]2). Happeline sool, mis kuumutamisel võib muuta selle tootmise reaktsiooni ja on väga ebastabiilne, välja arvatud lahuses. Kasutatakse laialdaselt keraamikatööstuses.
- Naatriumbisulfiit (NaHSO3). See sool on äärmiselt ebastabiilne ja hapniku manulusel muutub see naatriumsulfaadiks, mistõttu kasutatakse seda toiduainetööstuses toidu säilitusaine ja kuivatusainena. See on äärmiselt redutseeriv aine, mida inimene tavaliselt kasutab, kasutatakse ka värvide kinnitamisel.
- Kaltsiumtsitraat (Ca3[C6H5VÕI7]2). Tuntud kui mõru sool, kasutatakse seda toidukaitseainena ja toidulisandina, kui see on seotud aminohappe lüsiiniga. See on valge lõhnatu kristalne pulber.
- Monokaltsiumfosfaat(Ca [H2PO4]2). Värvitu tahke aine, mis on saadud kaltsiumhüdroksiidi ja fosforhappe reaktsioonil, Seda kasutatakse laialdaselt juuretisena või väetisena põllumajandustöödel.
- Dikaltsiumfosfaat (CaHPO4). Tuntud ka kui kaltsiummonivesinikfosfaat, on sellel kolm erinevat kristallvormi Neid kasutatakse toidus lisandina ja seda leidub hambapastades. Lisaks moodustub see loomulikult neerukivides ja nn hambaravi "kivis".
- Magneesiumfosfaat (MgH4P2VÕI8). Kasutatakse hapete, happesuse korrigeerija või jahude töötlemisel, see on lõhnatu kristalne valge sool, osaliselt vees lahustuv ja kasutatakse toidu säilitamisel.
- Naatriumdiatsetaat (NaH [C2H3VÕI2]2). Seda soola kasutatakse maitseainete ja säilitusainetena söögikordade ajal, vältides või viivitades seente ja mikrobakterite ilmnemist nii vaakumpakendis toodetes nagu lihatooted kui ka jahutööstuses.
- Kaltsiumvesinikkarbonaat (Ca [HCO3]2). Hüdrogeenitud sool, mis pärineb kaltsiumkarbonaadist, sisaldub mineraalides nagu lubjakivi, marmor jt. See reaktsioon tähendab vee ja CO olemasolu2, nii et see võib esineda spontaanselt koobastes ja kaltsiumirikastes koobastes.
- Rubiidiumhappefluoriid (RbHF). See sool saadakse vesinikfluoriidhappe (vesinik ja fluor X) ja leelismetalli Rubiidium reaktsioonil. Tulemuseks on mürgine ja söövitav ühend, mida tuleb käsitseda ettevaatusega..
- Monoammooniumfosfaat ([NH4] H2PO4). Vees lahustuv sool, mis on saadud ammoniaagi ja fosforhappe reaktsioonil laialdaselt kasutatakse väetisena, kuna see varustab mulda taimede kasvuks vajalike lämmastiku- ja fosforitoitainetega. See on ka osa tulekustutites sisalduvast ABC pulbrist.
- Tsinkvesinikortoboraat(Zn [HBO3]). Soola, mida kasutatakse antiseptiliselt ja lisandina keraamika tootmisel.
- Naatriumfosfaat (NaH2PO4). Kasutatakse laborites üle kõige, näitekspuhverVõi puhverlahus, mis hoiab ära lahuse pH järske muutusi.
- Kaaliumvesinikftalaat (KHP). Seda nimetatakse ka kaaliumhappe ftalaadiks, see on tahke ja stabiilne sool tavalises õhus, nii et kasutatakse sageli peamise standardina pH. See on kasulik ka puhverdusainena keemilised reaktsioonid.
See võib teile teenida:
- Mineraalsoolade ja nende funktsioonide näited
- Neutraalsete soolade näited
- Oxisalesi soolade näited